AMNOG-Bilanz 2024
Mehr als 1.000 Verfahren zur frühen Nutzenbewertung seit 2011
Von Januar 2011 bis Dezember 2024 initiierte der Gemeinsame Bundesausschuss (G-BA) 1.127 Verfahren zur frühen Nutzenbewertung von Arzneimitteln aus dem Neu- und Bestandsmarkt und führte 3.528 Beratungsverfahren durch. 31 von 92 Freistellungsverfahren endeten mit einer Freistellung des Arzneimittels von der Nutzenbewertung durch den G-BA.
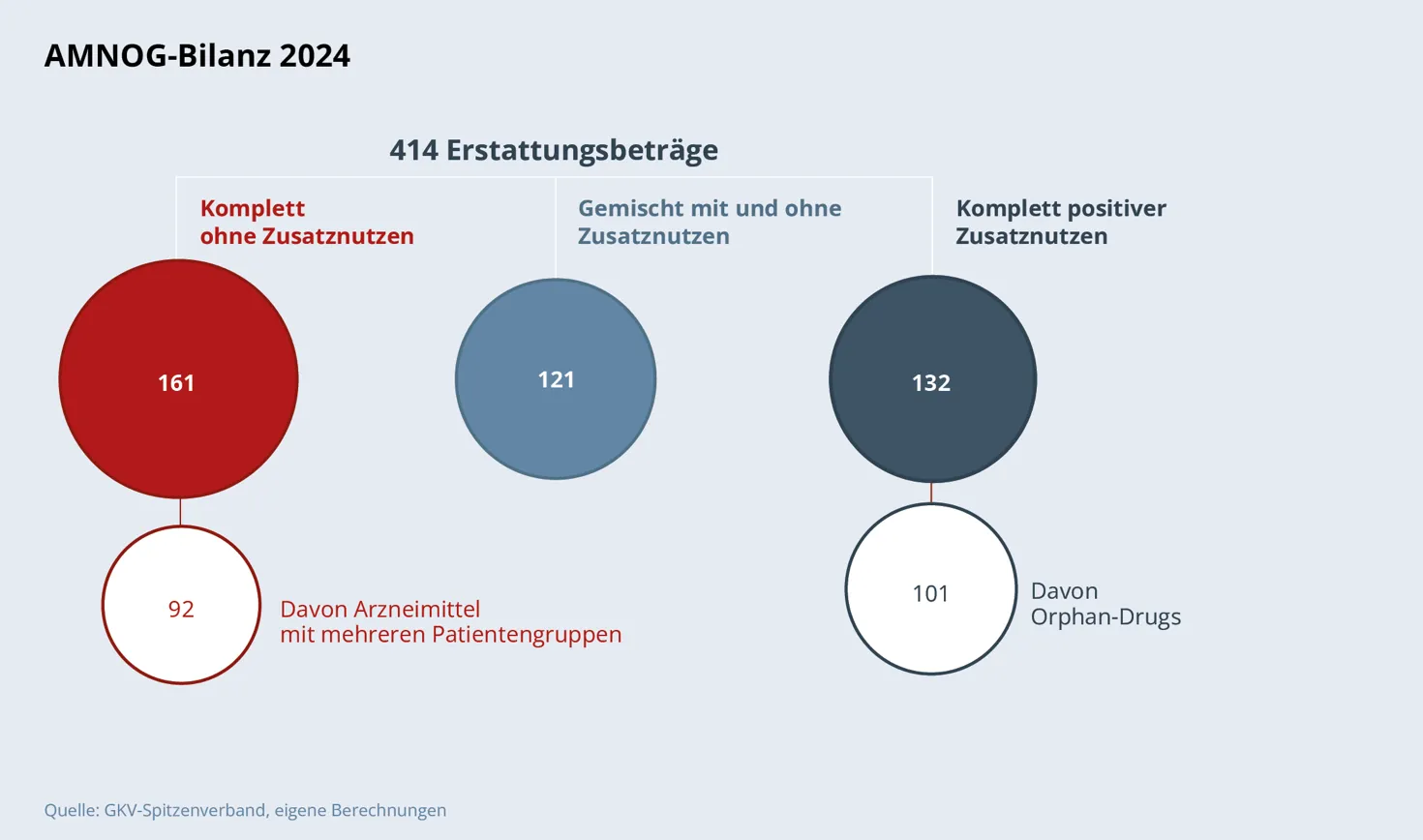
Zum Jahresende 2024 existierten zu 414 Wirkstoffen Erstattungsbeträge. Davon wurden 384 durch Einigung der Vertragsparteien erzielt, 29 Verfahren endeten mit einem Spruch der Schiedsstelle. 20 zunächst mit einem Erstattungsbetrag geregelte Wirkstoffe wurden in bestehende Festbetragsgruppen eingeordnet.
42 Prozent der Erstverfahren mit privilegierten Zulassungen
Privilegierte Zulassungen ermöglichen es bei Bestehen eines hohen medizinischen Bedarfs, Medikamente im beschleunigten Verfahren in Verkehr zu bringen, auch wenn deren Wirksamkeit und Sicherheit noch nicht ausreichend belegt sind. Ziel dieses Verfahrens ist die schnelle Behandlung, Vorbeugung oder Diagnose schwerer oder lebensbedrohlicher Krankheiten. Zu privilegierten Zulassungen zählen:
- bedingte Zulassungen (conditional market authorisation)
- Zulassungen unter außergewöhnlichen Umständen (exceptional circumstances)
- Zulassungen als Arzneimittel für seltene Leiden (Orphan drugs)
- neuartige Therapien (ATMPs wie Zell- und Gentherapien)
Bei Orphan Drugs erfolgt eine weitere Privilegierung in der Nutzenbewertung. Bis zur Überschreitung einer bestimmten Umsatzschwelle wird ein Zusatznutzen als nachgewiesen angenommen, wodurch eine Bewertung gegenüber einer zweckmäßigen Vergleichstherapie entfällt.
Patientensicherheit bleibt auf der Strecke
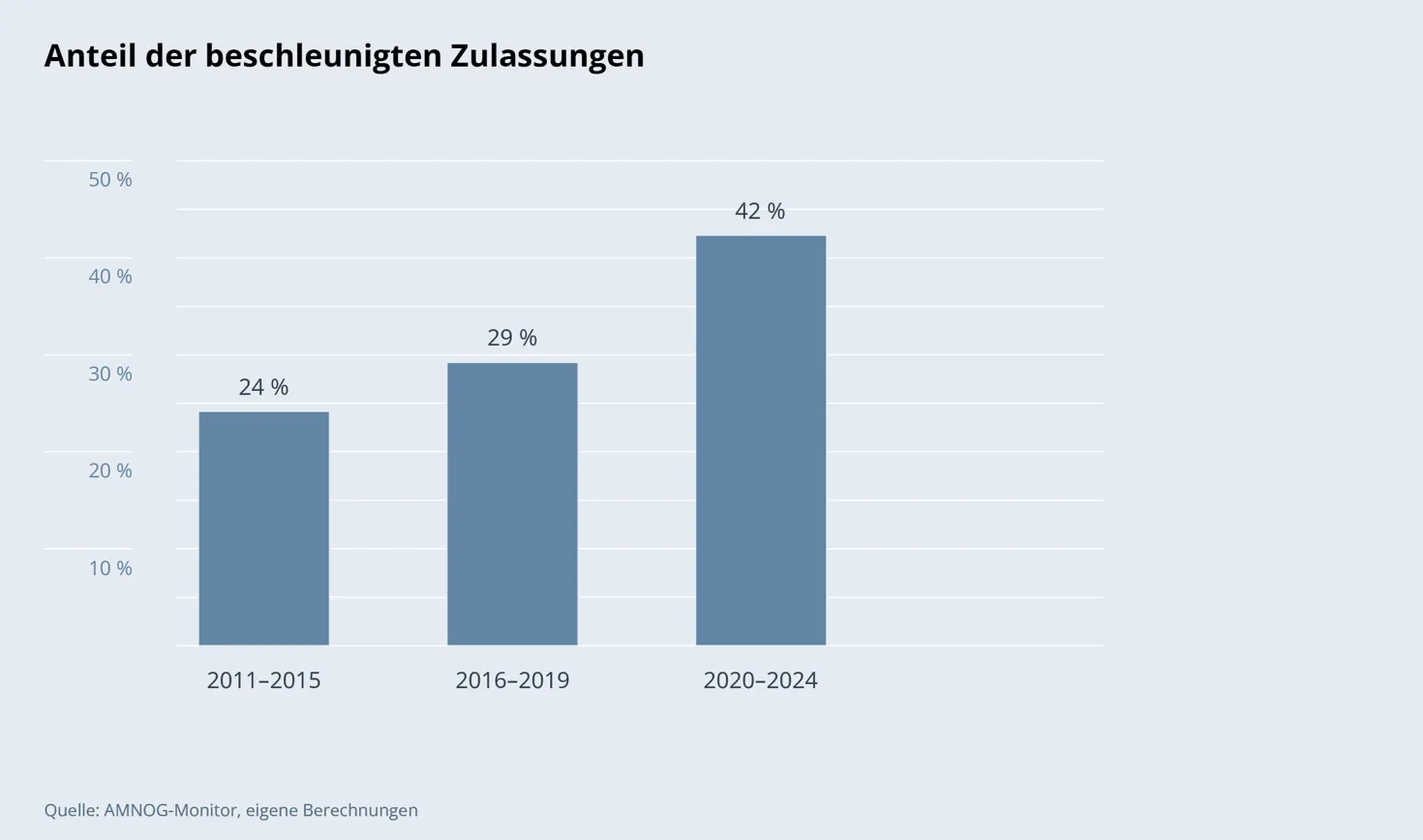
Das frühzeitige Inverkehrbringen nimmt dabei in Kauf, dass möglicherweise schwerwiegende Risiken unentdeckt bleiben oder Arzneimittel unzureichend wirksam sind. In den Erstattungsbetragsverhandlungen zeigt sich dieser bedenkliche Trend sehr deutlich. Wurden in den ersten Jahren des AMNOG lediglich 24 Prozent der Wirkstoffe mit Erstbewertung unter besonderen Bedingungen zugelassen, sind es seit 2020 im Schnitt bereits 42 Prozent. Im Jahr 2024 wurde sogar jeder zweite Wirkstoff, der einer Erstbewertung zugeführt wurde, im Schnellverfahren zugelassen.
Evidenzlücken zügig schließen
Pharmazeutische Unternehmen müssen seitens der Zulassungsbehörde dazu verpflichtet werden, klinische Studien zum Beleg von Nutzen und Sicherheit zeitnah nach der privilegierten Zulassung abzuschließen. Die Privilegierung von Orphan Drugs in der Nutzenbewertung sollte aufgehoben und eine Vollbewertung durchgeführt werden, um Transparenz zu schaffen über Wahrscheinlichkeit und Ausmaß eines Zusatznutzens gegenüber dem Versorgungsstandard. Darüber hinaus sollte insbesondere bei weiter bestehenden Evidenzlücken eine systematische Erfassung von Daten in Indikationsregistern erfolgen, um den tatsächlichen Nutzen in der Versorgung zu bestimmen.